••
|
|||||||
 |
| | أدوات الموضوع | انواع عرض الموضوع |
|
|
#11 |
|
مشرفة قسم تسالي والعاب
لاتتحدى انساناًليس لديه مايخسره
|
Y a g i m a بسم الله الرحمن الرحيم
السلام عليكم ورحمة الله وبركاته كيف حالكـم Rred moon و light moon ؟؟ إن شاء الله تمام و بصحة وعافية ؟؟ ماشاء الله موضوع جدجد جميل جدا موضع كامل جدا بس لو حطيتو امثال علي كل انواع الروابط الكيميائية لو كان هيك راح يفهمن اكثر امثال شرحها اسهل بكثثير من كتابة و و تصميم هيدر حميل جدا موضوع التنسيق الوان فيها المميز والطقم و رهيب و الجميل اللي سويته كيمياء هو ماددة مفضلة   عندي بس ماددة الفيزياء كرها كثثير عندي بس ماددة الفيزياء كرها كثثير   الرابطة الأيونية أو الرابطة الشاردية :- هي الرابطة التي تنشأ بين ذرتين تختلفان في المقدرة على كسب أو فقد الإلكترونات وتكون بين أيوني هاتين الذرتين الموجب والآخر السالب الشحنة فتنشأ قوة جذب كهربائي بينهما، وتختلف نسبة الأيونات المفقودة والمكتسبة فمثلا تحتاج ذرة الأكسجين لأيونين من البوتاسيوم لأن المدار الأخير يحتاج لإلكترونين ليصل لحالة الاستقرار أي ثمانية إلكترونات. 4K + O2 → 2 K2O وتحدث الرابطة الأيونية عادةً بين الفلزات (ذات طاقة التأين المنخفضة والتي تميل لفقدان الإلكترونات) واللافلزات (ذات الألفة الإلكترونية المرتفعة والتي تميل لاكتساب الالكترونات). مثال:- يرتبط أيون الصوديوم + Na بأيون الكلور - Cl في مركب كلوريد الصوديوم برابطة أيونية. Na + Cl → Na+ + Cl− → NaCl فعنصر الصوديوم يفقد الكترون واحد من مستوى تكافؤه ليصبح أيون موجب أحادي ذو توزيع الإلكتروني مشابه للتوزيع الإلكتروني للغاز الخامل الذي قبله وهو النيون. Na / 1S² 2S² 2P6 3S¹ ـ Na+ / 1S² 2S² 2P6 وعنصر الكلور يكتسب الكترون واحد في مستوى تكافؤه ليصبح أيون سالب ذو تركيب إلكتروني مشابه لتركيب الغاز الخامل الذي بعده وهو الارجون. Cl / 1S² 2S² 2P6 3S² 3P5 ـ Cl- / 1S² 2S² 2P6 3S² 3P6  الرابطة التساهمية هي إحدى أنواع الروابط الكيميائية التي تنشأ عن طريق مشاركة الشحنات بين ذرتين بهدف الوصول للاستقرار, تشكيل الرابطة الأحادية تقدم كل ذرة إلكترون تكافؤ، وعند تقديمه إياه يخرج من دائرة المدار الذري، ويصبح ضمن دائرة المدار الجزيئي للجزيء المتشكل.يمكن التعبير عن الرابطة الأحادية باستخدام أسلوب بنية لويس، حيث يشار إلى إلكترون التكافؤ بنقطة مثل AːA وعند تشكيل الرابطة يشار إليها بشرطة بين الذرتين A-A للتعبير عن الرابطة الأحادية. 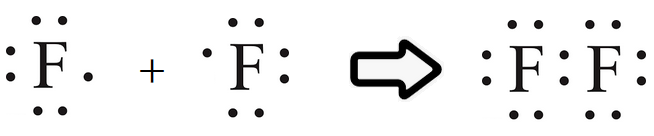 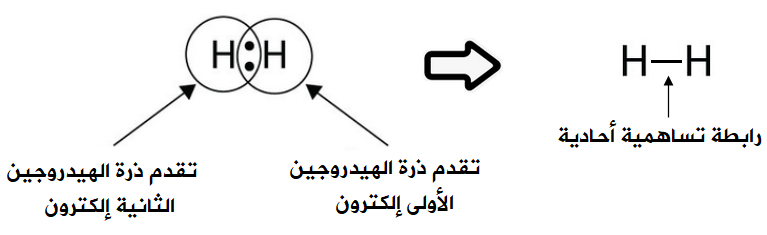 الرابطة الثنائية أو الرابطة المزدوجة في الكيمياء، هي عبارة عن رابطة كيميائية بين عنصرين بحيث تتضمن وجود أربع إلكترونات رابطة بدلاً من إلكترونين اثنين، كما هو الحال في الرابطة الأحادية. يرمز للرابطة الثنائية في الصيغة الهيكلية بخطين متوازيين يشبهان إشارة يساوي (=) توضع بين الرمز الكيميائي للذرتين المرتبطتين بهذه الرابطة. 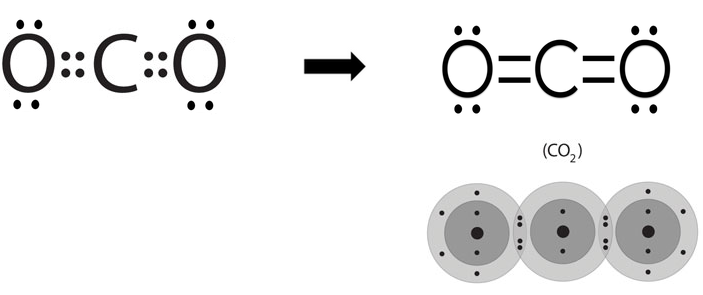 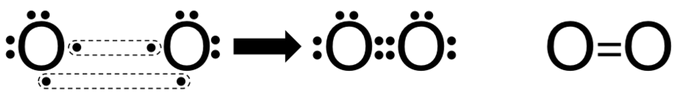 الرابطة الثلاثية في الكيمياء، هي رابطة كيميائية بين ذرتين حيث يتضمن ذلك الترابط الكيميائي وجود ست إلكترونات بدل وجود اثنين كما هو في الرابطة التساهمية الأحادية. يرمز للرابطة الثلاثية في الصيغة الهيكلية للمركبات على شكل ثلاثة خطوط أفقية متوازية (≡) بين الذرتين. من أشهر الأمثلة على الروابط الثلاثية مركبات الألكاين، والتي تتضمن وجود رابطة ثلاثية واحدة على الأقل بين ذرتي كربون. من الأمثلة الأخرى على الروابط الثلاثية في المجموعات الوظيفية كل من مركبات سيانيد وإيزوسيانيد. تعد الرابطة الثلاثية أقوى من الرابطة الأحادية ومن الرابطة المضاعفة، كما أنها أقصر، ولرتبتها مقدار 3. 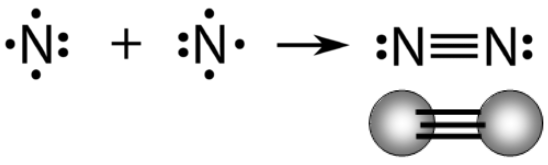 الرابط التناسقية أو الرابطة التساندية أو الرابطة التساهمية التناسقية هي نوع من أنواع الروابط التساهمية تتكون نتيجة مساهمة ذرة مع الأخرى بزوج من الإلكترونات غير المشتركة في روابط. تسمى الذرة التي تقدم زوجا من الإلكترونات بالذرة المانحة، والذرة الأخرى تسمى بالذرة المستقبلة والتي تقدم مدارًا فارغًا. وتنشأ هذه الرابطة بين الذرات لتكوين جزيئات، أو بين ذرة في جزيء وأيون، أو بين ذرة في جزيء وذرة في جزيء آخر ومثال عليها الرابطة في أيون الهيدرونيوم.  الرابطة الهيدروجينية أو الترابط الهيدروجيني هو ترابط يحدث بين الجزيئات التي تحتوي على رابطة تساهمية قطبية يشترط فيها تواجد احدى الذرات ذات الكهروسالبية العالية مثل فلور، اوكسجين أو نيتروجين مرتبط إلى الهيدروجين، ونظرا لصغر حجم ذرة الهيدروجين فان المزدوج الإلكتروني سوف ينجذب مع بروتون ذرة الهيدروجين الموجب مكون هذا النوع من الترابط. يرمز عادة الي الترابط الهيدروجيني بالرابطة الهيدروجينية نتيجة لقوة هذا الترابط حيث انه يحتاج 5-30 كجول / مول. انواع الروابط الهيدروجينة 1-روابط هيدروجينية داخلية :- وهي تحدث بين جزيئات لديها ذرة هيدروجين مرتبط إلى احدي الذرات التالية (N، F، O) برابطة تساهمية قطبية ومثال عليها الكحولات والامينات الأولية والثانوية والاميدات الأولية والثانوية والأحماض الكربوكسلية والماء وتسمي هذه الجزيئات عادة بمانح ومستقبل للرابطة الهيدروجينية.. 2-روابط هيدروجينية خارجية:- وهي تحدث في المركبات التي لديها ذرة (N، F، O) ولكن غير متصلة برابطة تساهمية قطبية مع الهيدروجين وبالتالي فانها تكون روابط هيدروجينة ولكن ليس مع نفسها وانما مع المذيب المستخدم إذا كان يوافق الشروط لحدوث الترابط الهيدروجيني ومثال علي هذه النوع الايثرات والامينات الثالثية والكيتونات والالدهيدات والاسترات والاميدات الثالثية. 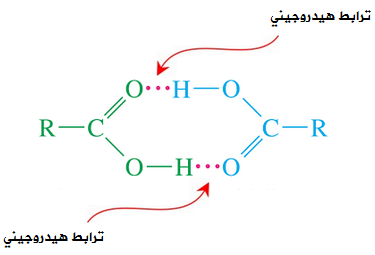 أنواع روابط فاندرفالس :- *تفاعلات كيسوم (Keesom)سميت بهذا الاسم تيمنًا بالعالم ويليم هندريك كيسوم وتتمثل بقوى التجاذب بين الجزيئات ثنائية الأقطاب الدائمة، فعند اقتراب جزيئين قطبيين من بعضهما البعض (يتكون كل منهما من جزءٍ موجبٍ وآخر سالب) فينجذب الجزء الموجب للجزيء الأول من الجزء السالب للجزيء الآخر، وينجذب الجزء الموجب للجزيء الثاني للجزء السالب للجزيء الأول وهكذا. تعتمد هذه التفاعلات على درجة الحرارة اعتمادًا كبيرًا، وتندرج الروابط الهيدروجينية كأحد أنواع تفاعلات كيسوم كونها تنطوي على تفاعلاتٍ بين الأقطاب الدائمة. *قوى ديبي (Debye) :-سميت بهذا الاسم نسبةً إلى الكيميائي الهولندي الأمريكي بيتر ديبي، وتحدث نتيجة التفاعل بين الأقطاب الدائمة وغيرها من الذرات والجزيئات، مما يؤدي إلى تشكيل ثنائيات اقطاب مستحثة نتيجة قوى التنافر بين الإلكترونات التي تنتمي إلى أحد الجزيئات وثنائي القطب الدائم. على عكس تفاعلات كيسوم؛ فإن قوى ديبي لا تعتمد على درجة الحرارة. *قوى لندن :-والتي تدعى أيضًا بقوى تشتت لندن. تعتبر أحد أنواع قوى فاندرفالس أيضًا وهي الأضعف من حيث القوى الجزيئية؛ كونها تظهر نتيجة حدوث حالة استقطاب آنية لا تلبث أن تزول في غضون لحظاتٍ بسبب تكون ثنائي قطب لحظي. تتمثل بالقوى الجزيئية التي تحدث بين الذرات والجزيئات غير القطبية نتيجة لحركة الإلكترونات، إذ تنجذب إلكترونات أحد الجزيئات إلى نواة الآخر، في حين يحدث تنافرٌ كهربائيٌّ بينها وبين الإلكترونات المدارية لذلك الجزيء، وترتبط زيادة معدل هذه القوة بزيادة حجم الجزيء أو الذرة، فتزداد قوى التشتت في الجزيئات أو الذرات الكبيرة عن تلك الأصغر حجمًا. خصائص روابط فاندرفالس :- *أضعف عمومًا من الروابط الثنائية والأيونية. *لا تعتمد على درجة الحرارة، باستثناء قوى كيسوم (التفاعلات بين ثنائي القطب وثنائي قطب آخر). *قوى قصيرة المدى، تزداد باقتراب الجزيئات أو الذرات من بعضها البعض. *عبارة عن قوى تراكمية. *إنّ روابط فاندرفالس غير متجهةٍ. العوامل المؤثرة على قوى فاندرفالس:- *عدد إلكترونات الذرات أو الجزيئات: تساهم زيادة عدد الإلكترونات في تشكيل المزيد من الأقطاب المؤقتة والتي تزيد بدورها من قوى فاندرفالس. *شكل الجزيء: تميل الجزيئات الطويلة غير المتفرعة إلى أن تتميز بقوات تشتتٍ أكبر من تلك المتفرعة والقصيرة. اتمنى لكِ التقدم والابداع فى انتظار جديد في مواضيعكِ في أمـآن الله و حفظـه #تَضارب على توازي |
|
التعديل الأخير تم بواسطة ياجْـي الـكيّـوته. ; 07-12-2020 الساعة 07:07 PM

|
|
|
#12 | |
|
مُشرفة قسم التسالي والألعاب
|

 |
|
"أفهمني أنا لستُ كالعالم التقليدي أنا لدي جنوني وأعيش في بُعد آخر وليس لدي الوقت للأشياء التي بلا روح."
التعديل الأخير تم بواسطة Rouna ; 06-30-2022 الساعة 02:37 PM

|
 |
« الموضوع السابق | الموضوع التالي »
|
|
 المواضيع المتشابهه
المواضيع المتشابهه
|
||||
| الموضوع | كاتب الموضوع | المنتدى | مشاركات | آخر مشاركة |
| ✠ سَأرويك من مناهِل العلم - تعريف | قوانين | مستجدات ✠ | URANUS | علوم و طبيعة | 1 | 05-11-2020 12:22 PM |
الساعة الآن 02:25 PM











 العرض العادي
العرض العادي