تنبيه: سيتم إغلاق المنتدى بشكل نهائي في 10 ابريل
|
|||||||
 |
| | أدوات الموضوع  | انواع عرض الموضوع  |
|
|
#6 | |
|
مشرفة قسم تسالي والعاب
لاتتحدى انساناًليس لديه مايخسره
|
|
|
|
التعديل الأخير تم بواسطة JOKER. ; 04-09-2022 الساعة 02:24 AM

|
|
|
#7 | |
|
مشرفة قسم تسالي والعاب
لاتتحدى انساناًليس لديه مايخسره
|
|
|
|
التعديل الأخير تم بواسطة JOKER. ; 04-09-2022 الساعة 02:31 AM

|
|
|
#8 | |
|
مشرفة قسم تسالي والعاب
لاتتحدى انساناًليس لديه مايخسره
|
|
|
|
التعديل الأخير تم بواسطة JOKER. ; 04-09-2022 الساعة 03:18 AM

|
|
|
#9 | |
|
مشرفة قسم تسالي والعاب
لاتتحدى انساناًليس لديه مايخسره
|
|
|
|
التعديل الأخير تم بواسطة JOKER. ; 04-09-2022 الساعة 02:09 AM

|
|
|
#10 | |
|
مشرفة قسم تسالي والعاب
لاتتحدى انساناًليس لديه مايخسره
|
|
|

|
 |
« الموضوع السابق | الموضوع التالي »
|
|
الساعة الآن 10:57 AM






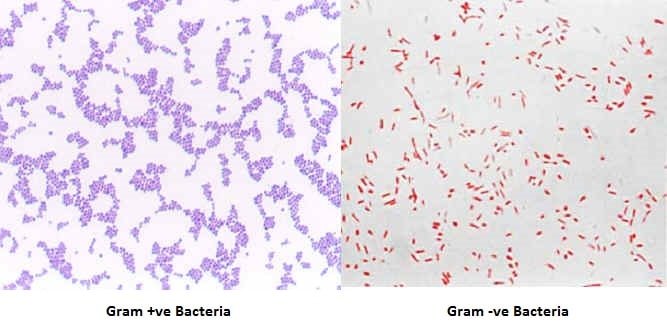
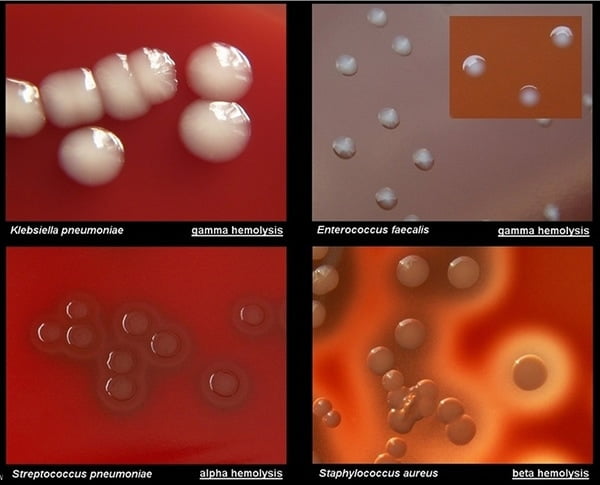
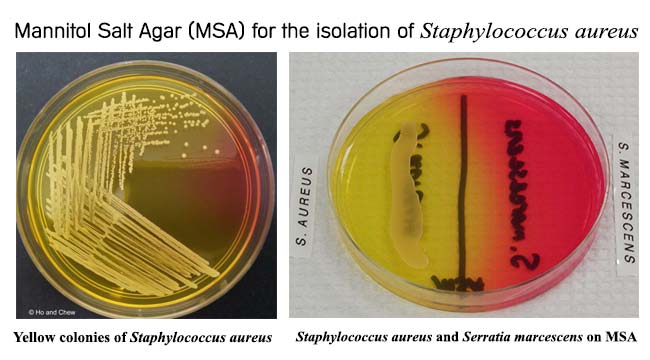
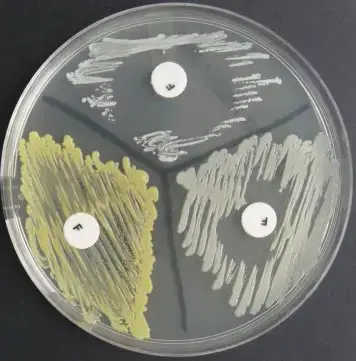


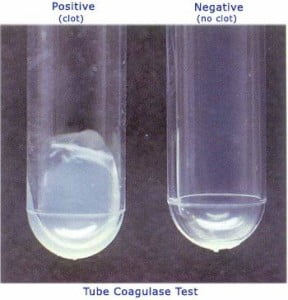
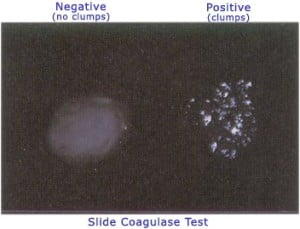
 العرض العادي
العرض العادي